INTERVIEW
知財インタビュー
2020.08.03
知財インタビュー
Vol.1
遺伝子改変マウスの作成を効率化
遺伝子異常と病気の相関 研究前進に寄与

「簡便で高効率の遺伝子改変非ヒト哺乳動物の作製方法」(特許番号: 6190995)と「遺伝子ノックイン細胞の作製方法」の特許をお持ちの田中光一先生。従来の遺伝子改変マウスの作成方法を、どのような工夫で効率化したのか詳しくうかがいました。
- プロフィール
-
東京医科歯科大学
難治疾患研究所
分子神経科学分野
教授
田中光一先生
研究について
まずは、先生の研究について教えていただけますでしょうか。
- 田中:
- 精神・神経系疾患のモデルマウスを使って、共通した異常のあるグルタミン酸を中心に、疾患の病態を解明して新しい治療薬を見つける研究をしています。
精神疾患に興味がありました。精神科は今でも治らない病気がほとんどで、精神科の臨床に携わった際に、治せないということに歯がゆさを感じました。そこで研究して患者を治したいという思いで基礎研究を始め、今に至ります。
患者さんの薬を開発する上で、モデルマウスの評価が重要になるのだと思いますが、臨床の現場からモデルマウスの研究に変えた理由はどのようなことだったのでしょうか。
- 田中:
- 臨床で使っている薬は精神疾患の患者を「治す」ことはできません。薬は症状を抑える
ためのものです。現在使われている抗精神薬は、私が40年前に使っていたものと作用機序としては同じものです。ずっと同じ薬を使っていても埒があかないと思い、新しい作用機序の治療薬を作りたいと思うようになりました。
マウスを使ってモデルを作るというところが重要で、知的財産に関わる部分だと思います。
改めて研究の概要を教えて下さい。
- 田中:
- 世の中にさまざまな病気がありますが、アメリカのオバマ前大統領が「プレシジョン・メディシン(Precision Medicine、精密医療)」を推進してから、多くの研究者がこの分野に一生懸命取り組み始めました。プレシジョン・メディシンとは、最先端の遺伝子解析技術を使って、病気を遺伝子レベルで分析し、個々の患者に応じた薬を投与して治療を行うことを言います。
私たちは癌や糖尿病の他に、うつ病、認知症などの病気を克服していく必要があります。これらが難しい病気なのは、遺伝子因子だけ、環境因子だけで決まらず、両方が複雑に関係していることも関係しています。単純に一つの遺伝子の欠陥なら話が早いですが、多くの遺伝子が複雑に関与しています。さらに、環境の要因も関係してくるので非常に難しいです。
プレシジョン・メディシンで、これらの病気をどのように攻めていくのでしょうか。
- 田中:
- 「コホート研究(研究対象とする病気にかかっていない人を大勢集め、将来にわたって長期間観察し追跡を続けること)」と関係があります。100万人の健康情報を集めて、5年、10年、15年、20年と追い続け、どういう因子が病気と関係するのかを調べる研究計画です。健康情報とはゲノム情報、病歴、生活習慣のことですね。現時点で一番確実な健康情報は、遺伝子情報です。つまり、この病気にはどの遺伝子のどの配列が関係しているかを突き止めることです。
環境要因は複雑なので、まずは遺伝的要因、そのあと環境要因という順で調べます。この研究計画は進んでいて、遺伝子であればこの配列があれば認知症になる確率が高いなど分かり始めているんです。DNAの配列を調べて健康診断のようなことをやっている企業もあります。
遺伝子の配列の研究は、どの程度まで進んでいるのでしょうか。
- 田中:
- 病気の人と病気でない人の遺伝子の配列を比べることにより、病気の人に多く見つかる遺伝子の配列はわかります。しかし、その遺伝子の配列の違いがうつ病や認知症の発症にどのように関わるのかまではまだ理解されていません。というのも、遺伝子の機能について大部分がまだ解明されていないんです。ある遺伝子配列を持っている人が、将来、どのくらいの確率で認知症になるかは統計的に類推できますが、その情報だけでは認知症を治せるかどうかは全く分かりません。変異した遺伝子がどういうメカニズムで認知症を引き起こすのか、という「病態のメカニズム」が分からないと、病気の克服はできません。そのためにどうしても必要なのが「モデル動物」です。遺伝子の異常を再現したモデル動物を使って、詳しいメカニズムを調べることが大事です。遺伝子解析はシーケンサーという機器の発展によって進んでいますが、病気の克服にはモデル動物を使って病気の発症メカニズムを明らかにする必要があります。
モデル動物の作成に労力と時間がかかることが、研究のボトルネックになっています。
今の先生の研究には、どのようにつながっているのでしょうか。
- 田中:
- 8年前(2012年)までは、ES 細胞(胚性幹細胞)を使わなければ遺伝子を改変したマウスが作れず、当時はそのマウスを1つ作るのに約2年かかっていたのです。しかし、2012年に「CRISPR/Cas9」というゲノム編集方法が発表され、2013年から応用され始めてからは、約1ヶ月で遺伝子改変マウスが作れるようになりました。
こうしてボトルネックは少し解決したわけですが、CRISPR/Cas9は万能ではなく、この技術にもまだ制約がありました。このCRISPR/Cas9を改良して応用範囲を広げたのが私たちの研究です。
遺伝子の改変は大きく3種類に分けられます。1つめは「遺伝子欠損」。改変したい遺伝子の一部を削って機能をなくします。2つめは「1塩基置換」。遺伝子の中の1塩基が「A」から「G」に変わるような遺伝子改変です。3つ目は「ノックイン(遺伝子挿入)」。外来の遺伝子を標的の部位に挿れるという遺伝子を改変する方法です。
CRISPR/Cas9は「遺伝子欠損」と「1塩基置換」に関して世界中から50%〜60%程度の改変が成功したと報告されています。しかし、外来の遺伝子を任意の部分に挿れる「ノックイン」という方法は当初アメリカのグループが16%できると発表しました。ところが、2019年に約20のマウスを作る施設のノックインマウスの作成効率を調べたところ、成功率は0.87%でした。つまり100匹の生まれたマウスの中で、目的のノックインマウスは1匹いるかどうかということです。このことが示しているのは、ある程度の長さを持った外来遺伝子を目的の遺伝子部位に挿れるのは難しいということです。それを何とか解決しようと考えたのです。
遺伝子を目的の部分に挿れることが、なぜ重要なのでしょうか。
- 田中:
- 「ヒト化動物モデル」というもので説明します。ヒトとマウスは遺伝子が違います。ヒトと同じ抗体を持ったマウスをつくることができれば、ヒトの抗体に関する研究ができる。ヒトとマウスは薬物を代謝する酵素が違うので、マウスを使って新しい薬物の代謝を調べることができません。しかし、マウスの酵素をヒトの酵素に入れ換えることができればマウスで新しい薬物の代謝実験ができるというわけです。
いま(2020年6月時点)流行している新型コロナウイルスでも同じことが言えます。新型コロナウイルスはアンジオテンシン変換酵素2(ACE2)という遺伝子を受容体にして、細胞に感染します。このアンジオテンシン変換酵素2は、ヒトもマウスも持っていますが、配列が異なり、新型コロナウイルスはヒトのアンジオテンシン変換酵素2でなければ感染しません。なので、本来はマウスを使った実験はできませんが、マウスのアンジオテンシン変換酵素2をヒトのものに置換できれば、マウスを使って新型コロナウイルスの研究できるのです。
もう1つ大切なことは、2000年代前半に流行した「遺伝子治療」。免疫細胞であるリンパ球の機能が生まれながらに悪い子どもがいます。その中の患者さんに、ある酵素に変異がありリンパ球が機能しない子供達がいます。正常な酵素を挿れれば治るのでは、と、リンパ球に正常な酵素遺伝子を挿れて患者さんに戻したところ、見事に治りました。しかし、治療した子供の一部が白血病を発症しました。当時は外から遺伝子を入れる場合どこに挿れるかをコントロールできなかったため、偶然癌を抑制する遺伝子に挿入されてしまい、癌抑制機能がなくなり、白血病を発症しました。
それ以来遺伝子治療は下火になりましたが、CRISPR/Cas9(クリスパー・キャスナイン)が出てきてから、目的の場所に遺伝子を挿入できるのであれば、治療法として非常に有用なのでは、ということで最近復活してきています。ただ、ある程度大きい遺伝子を特定の部位に挿れることに関しては効率が悪い状況でした。
田中先生のご研究は、ある程度の大きさの遺伝子を、目的の部分に挿入する効率を上げたということなのですね。どのような工夫をされたのでしょうか。
- 田中:
- まず、ゲノム編集について説明します。ゲノム編集は、自由にゲノムの配列を換える技術です。目的の部分の遺伝子を効率よく変えるために、まずは目的の部分の遺伝子を切る必要があります。遺伝子が切られると修復機構が働き、その部分に外から入れた遺伝子が組み込まれやすくなります。従って、ゲノム編集を効率化することは、目的の遺伝子部位を効率よく切ることです。しかし、人間の細胞内には30億の塩基対(ATGC)があり、目的の部位の一箇所だけ切断することは難しかったです。2012年に、CRISPR/Cas9という細菌の持っている免疫システムを用いると、効率よく標的
遺伝子部位を切断できることが報告されました。
CRISPR/Cas9を、どのように改良したのでしょうか。
- 田中:
- Cas9は、細菌が持っているDNAを切る酵素です。細菌は感染したウイルスから自身を守るため、ウイルスのDNAをCas9を用いて切断します。では、どのようにウイルスのDNAだけを切断できるのでしょうか?Cas9をウイルスの遺伝子にリクルートさせDNAを切断するには、2種類のRNAが必要です。1つはCrispr RNA(crRNA)といってウイルスのDNAと相補的な配列を持っているRNAです。しかし、 crRNAはCas9と複合体を作ることができないので、それを仲介するtrans-activating crRNA(tracrRNA)が必要です。tracrRNAはcrRNAとCas9の両方と結合することができ、tracrRNAが仲介役となりCas9、crRNAが複合体を形成し、ウイルスの遺伝子にCas9がリクルートされ、ウイルスのDNAが切断されます。この細菌の持っているCRISPR/Cas9システムは、ウイルスDNAだけでなく、全ての生物の持つDNAにおいて、目的の部位を切断できることが示され、ゲノム編集に応用されました。目的部位を切断する際に、配列を変えた外来遺伝子を同時に入れると、切断された目的部位に外来遺伝子が取り込まれます。
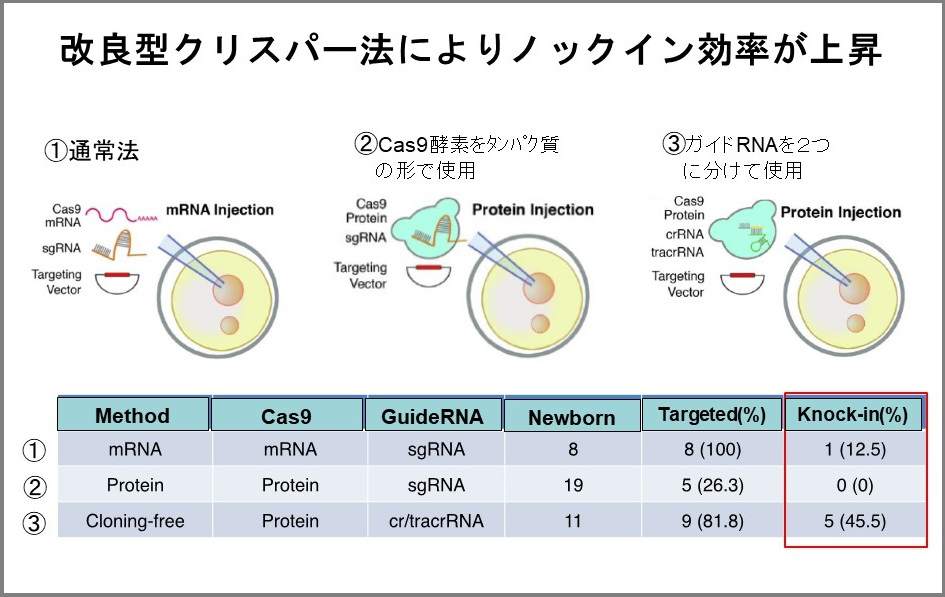
- ノックインの効率が悪かった従来型では、Cas9というタンパク質はメッセンジャーRNA(mRNA)として細胞に挿れ、crRNAとtracrRNAの2種類のRNAは人工リンカーを使って1本のRNAにしていました。これを「1本鎖ガイドRNAまたはシングルガイドRNA(sgRNA)」といいます。実験的には非常に楽なので、Cas9を内包したmRNAとsgRNAを挿れて目的の部分に傷をつけます。
その時に配列を組み換えた「鋳型DNA」を一緒に挿れると遺伝子の配列が入れ替わります。
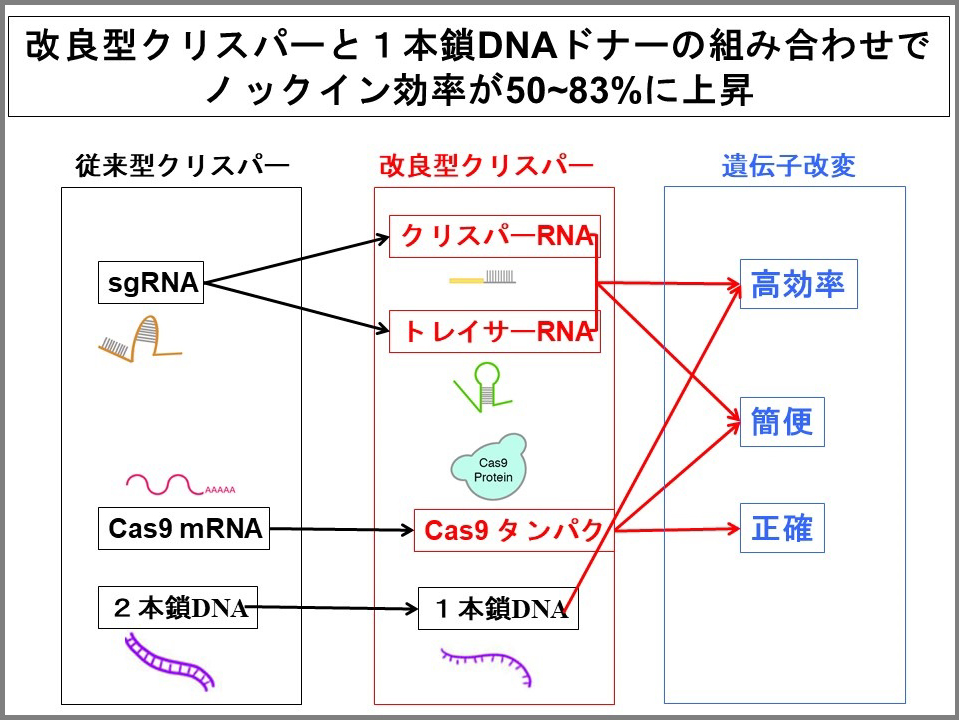
- 私たちが改良したのは2点です。
1つは、Cas9をmRNAではなくタンパク質として挿れることにしました。傷をつけた場所に外来のDNAが取り込まれるのは細胞周期の限られた時期でしか発生しません。mRNAでCas9を挿れると、細胞に入ってタンパク質に翻訳された後に働くのでタイムラグが生じます。タンパク質として直接挿れればすぐに酵素活性を発生できます。
2つめは、実験の都合上1本にしたRNAを自然界の状態と同じく2分割しました。複合体を作る場合、RNAの立体構造が大事です。無理矢理2つのRNAをつけてしまうと立体構造が不自然になってしまうので、自然の状態に戻した方が効率よく目的の部分を切ることができると想定して分けたのです。
ノックインの2つの実験結果をご紹介します。
1:
従来型のCas9はmRNAで、RNAは1本鎖ガイドRNAで挿れると、生まれてきたマウス8匹のうち1匹がノックインに成功しました。
2:
Cas9をタンパク質に変えてRNAをcrRNAとtracrRNAの2種類の状態に戻した場合、生まれてきたマウス11匹のうち5匹、つまり45.5%の効率でノックインに成功しました。
つまり上記の改良により、外来の遺伝子を目的の場所にノックインする効率が非常に向上しました。さらに、Cas9をmRNAではなくタンパク質として挿れたことにより、細胞の中でCas9が働く時間が短くなり、目的以外の場所を傷つけてしまう「オフターゲット」の可能性が下がり、正確性が上がりました。また、sgRNAを2分割したことにより、RNAの化学合成が可能になり、簡便性も向上しました。
また、鋳型DNAとして2本鎖DNAと1本鎖DNAのどちらがいいのかを調べたところ、1本鎖DNAの方が効率がよく、様々な標的遺伝子部位で50%〜83%の高い確率でノックインに成功しました。以上をまとめると、Cas9をタンパク質に変え、RNAを2種類(crRNAとtracrRNA)の自然な状態に戻すことに加えて、鋳型DNAとして1本鎖DNAを使用することでノックインの効率が大きく上昇することが分かりました。
この技術を発表して企業や学会からどんな反響がありましたか。また、コラボレーション
する企業のイメージはございますか。
- 田中:
- 2つの特許のうち、1つは日本で成立していますが、もう一つはPCT国際出願が終わって海外各国で成立させようと動いている段階です。 遺伝子改変マウスを受託で作製する企業が、この技術を使いたいと申し出てくれました。製薬会社からもこの技術で色んな疾患モデルを作りたいというお話をいただきました。
また、遺伝子導入動物(トランスジェニック動物)を作製するある企業はこの技術をライセンスとして持ち、トランスジェニック動物を数多く作っているようです。この技術ライセンスを取得したいと言っている日本の大手製薬会社がいるとも聞いています。海外では、アメリカの希少疾患の団体に研究目的でライセンスしています。
コラボレーションの可能性としては、上記の企業の他にはベンチャーキャピタルのような企業が良いかもしれませんね。私自身が起業する予定はないですが、そういう理解がある人にサポートしてもらえると助かると思います。
モデル動物で調べたことが最終的に患者でどうなるか、モデル動物で効果のある化合物が見つかった時に、ヒトに効くのかといった連携ができればうれしいですね。基礎研究と臨床研究の連携の効率化が、日本では不十分です。
この特許の技術で、どのような広がりを期待していますか。
- 田中:
- 効率が上がったことそのものが、イノベーションだと思っています。従来であれば、研究者人生30年間で、ES 細胞を用いた遺伝子改変マウスは10系統ほどしか作れませんでした。
この技術で100系統、200系統を作ることが可能になり、研究の幅が広くなります。
遺伝子配列のデータはすごい勢いで蓄積されていますが、その意味付けが追いついていない。モデル動物の作成を効率化させることにより、遺伝子配列の違いと疾患病態の関連づけが解明され、疾患の克服が加速化されることを期待しています。
認知症や自閉症など精神疾患の領域で実現していきたいモデルなどはありますか。
- 田中:
- 遺伝的要因の関与が大きい病気、自閉症や統合失調症ですかね。マウスで精神疾患を再現するには限界があるので、よりヒトに近い霊長類を用いた精神疾患モデルの作成と解析が、今後の課題だと思います。認知症の場合は、遺伝子異常のはっきりしている家族性アルツハイマー病モデルを用いて研究が進められてきましたが、モデルの妥当性に疑問が持たれています。認知症に関しても、霊長類モデルが今後、必要になってくると思います。
産学連携でのご経験はございますか。
- 田中:
- 緑内障の研究をしていましたが、効きそうな化合物を確かめてくれる企業がなかなか現
れませんでした。緑内障や認知症は効果を確かめるために3〜4年かかります。それだけの時間と費用を投資して成果が出なかったら、と尻込みしているようです。認知症は大きな製薬会社でさえも、「投資しても回収できるか分からない」と匙を投げている状況です。日本だけでなく、世界的にもこんな感じです。
最後に
先生のご趣味や、「こんな仲間が欲しい」といったことがあれば教えてください。
- 田中:
- 趣味は研究ですね(笑)。今までモデル動物を研究してきたので、また患者さんを診ることができれば、と思っています。
自分のやってきた研究がどれほど臨床に還元できるのか知りたい。初めて精神疾患の患者さんを診た時の無力感が、少しでも改善されることを期待しています。

ありがとうございました。
CONTACT
東京科学大学医療イノベーション機構に関するお問い合わせ、お申し込みは下記フォームにご入力ください。
